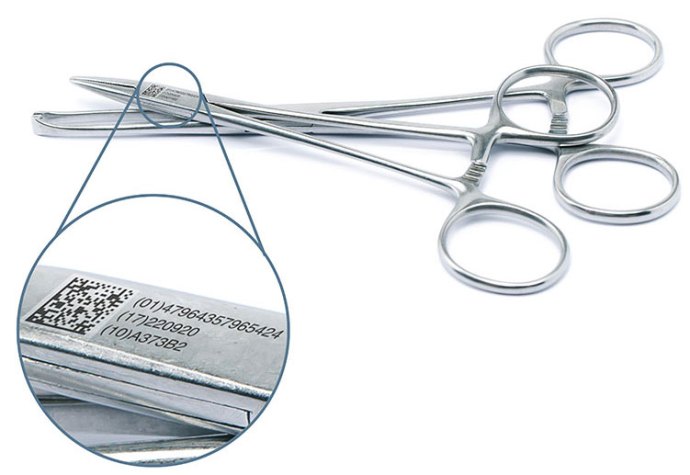
什么是UDI
唯一器械标识(Unique Device Identification,缩写 UDI)是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保障患者安全
Veralto UDI 整体解决方案视频

我们的优势
UDI为何如此重要?
- 减少医疗差错;
- 简化将器械使用信息集成到数据系统的操作,识别出现不良事件的医疗器械;
- 更加迅速地为已报告的问题制定解决方案,实现重点突出且有效的安全沟通;
- 安全访问明确器械标识信息的原始来源
伟迪捷的优势
- 提供UDI法规咨询,UDI编码规则指导,UDI整体方案设计。
- 自主设计研发的UDI软件及相关赋码硬件:TTO/CIJ/LASER/TIJ/LPA
- 拥有能够匹配客户现有生产线进行集成,或提供定制化改造升级的能力。
- 软件可对接国家药监局UDI数据库,拓展对接企业ERP/WMS/MES等系统。
- 拥有自己的软件、硬件、服务团队,从项目开始到交付实现一站式交钥匙工程。
- 基于UDI载体,可拓展实现从生产–流通–医院终端等一列追踪追溯需求。
伟迪捷可以帮助您确定您的生产线适用的理想解决方案。伟迪捷与多家重要 OEM 密切合作,有助于确保我们的打码机无缝集成到您现有的包装线,并确保您的 UDI 喷码流程完美匹配您的业务需求。
- 常见问题
- 企业UDI实施步骤
- 文档
- 客户成功案例
关于UDI的常见问题
Q1:医疗器械UDI要求做到一物一码吗?
答: 目前往UDID数据库只上传静态的DI产品标识信息,动态PI信息由企业现场生成。企业根据产品的特点,有些产品只关联到批号。有些高风险植入类产品需要标识到序列号。如果标识到序列号,则可以做到一物一码。
Q2: 医疗器械企业如何上传DI及相关数据到UDID数据库?
答:医疗器械唯一标识管理信息系统为注册人/备案人提供三种数据申报途径。
- 网页填报:注册人/备案人登录系统后,直接在网页填报提交。
- 批量导入:注册人/备案人登录系统后,下载系统提供的数据模板,注册人/备案人按照要求准备好数据,再通过数据模版批量导入功能批量导入数据。
- 申报接口:系统提供API接口申报数据。
Q3: 医药器械哪些地方需要进行UDI赋码?
答: 医疗器械最小销售单元和更严级别的包装或者医疗器械产品上赋予唯一标识数据载体。
Q4:医疗器械企业一定要通过UDI做关联和追溯系统吗?
答:目前国家政策鼓励企业通过唯一标识建立健全追溯系统,追溯到批次,需要包含批次号,追溯到单品,需要包含序列号。
Q5: 注册人/备案人可采用什么方式填报数据?
答:可采用网页填报、数据模板导入和数据接口交换三种方式填报。(YY/T 1752-2020 医疗器械唯一标识数据库填报指南)伟迪捷UDI数据管理平台可以按照数据接口交换的方式完成填报,并且填报内容格式与药监局要求一致。
Q6: 注册人/备案人是否需要上传PI信息至医疗器械唯一标识数据库?
答:“注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。” (《医疗器械唯一标识系统规则》第十五条)根据YY/T 1752-2020《医疗器械唯一标识数据库基本数据集》,注册人/备案人应在填报数据库时选择生产标识是否包含批号、序列号、生产日期、失效日期。
Q7: 实施了 UDI 是否就实现了追溯?
UDI 系统可实现医疗器械标识和产品主数据的记录,实施追溯还需要供应链各环节通过追溯系统对产品的历史记录、位置或应用信息进行记录。伟迪捷在追踪追溯领域深耕多年,可利用UDI的数据载体拓展完成全流程追踪追溯。
Q8: 哪一些数据需要上传到药监局?是否一定要跟ERP对接?
注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。” (《医疗器械唯一标识系统规则》第十五条)
即:DI要上传数据,PI是要告知包含的字段。
是否要跟ERP对接,由各个企业自己来去拟定的,这不是一个强制性的要求。
Q9: 上传药监局前需要做哪些准备工作?
- 申请厂商识别代码
- 根据国标分配DI
- 根据国标分配PI
- 生成UDI
Q10: UDI的打印质量有什么等级的要求吗?
标识数据载体的打印质量接受等级有具体的标准 一维码打印质量接受等级(GB/T 18348-2008商品条码条码符号印制质量的检验)、二维码打印质量接受等级(GB/T 23704-2017二维条码符号印制质量的检验)可接受符号等级标准≧1.5,也就是通常描述的≥C级
Q11: GS1中UDI的PI顺序是如何确定的?
当 UDI-PI 中既有预定义长度应用标识符(如失效日期、生产日期),也有非预定义长度应用标识符(如批号、序列号)时,应将预定义长度应用标识符放在前面。
企业UDI实施步骤
实施唯一标识的流程
第一步:注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码机构。
第二步:注册人/备案人按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
第三步:《规则》实施之日起,申请医疗器械注册、注册变更或者办理备案的,注册人/备案人应当在注册/备案管理系统中提交产品标识。
第四步:注册人/备案人根据发码机构标准选择适当的数据载体,对医疗器械最小销售单元和更严级别的包装或医疗器械产品上赋予医疗器械唯一标识数据载体。
第五步:注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
第六步:产品标识及数据相关信息变化时,注册人/备案人及时更新医疗器械唯一标识数据库。

UDI 产品手册
联系我们
售前咨询: 400-920-2377
售后咨询: 400-886-8099